问: 如何溶解多肽?
答: 我们建议在溶解之前用蒸馏水或无菌水进行小试,对于较短的寡肽(小于5aa)常常能够直接溶解。对于其他的多肽,大多需要根据多肽的序列优化溶解条件,并测试几种不同的溶剂,直至找到最优方法(超声处理有助于打碎颗粒,增加溶解度)。
多肽的极性对溶解度有很大的影响:酸性的蛋白易溶解于碱性溶液,而酸性溶液则适合碱性蛋白。可以用下表
 :
:
按上述原则,得分大于0为碱性多肽,得分小于0的为酸性多肽,得分为0为中性多肽。
举例说明:
RKDEFILGASRHD: (+5) + (-4) = +1 认为是碱性多肽
EKDEFILGASEHR: (+4) + (-5) = -1 认为是酸性多肽
AKDEFILGASEHR: (+4) + (-4) = 0 认为是中性多肽
1. 对于碱性多肽,如果纯水无法溶解,请尝试10% - 30%的醋酸;如果多肽还是不溶,测试纯醋酸和三氟乙酸TFA(<50 μl)来溶解,然后将多肽溶液稀释到需要的浓度。
2. 对于酸性多肽,如果纯水无法溶解,请尝试13% 氨水(v/v)来溶解,并稀释至所需浓度。如果多肽序列中包含半胱氨酸Cys(C),不能用氨水溶解,需使用二甲基甲酰胺(DMF)或N-甲基吡咯烷酮 (NMP)进行溶解。对于容易聚集的多肽,则选择6M的胍盐酸(guanidine?HCl)或8M的尿素(Urea)来溶解,然后稀释到需要的浓度。
3. 中性多肽应选用机溶剂来溶解。首先,尝试使用乙腈 (acetonitrile) ,或甲醇 (methanol) 或异丙醇 (isopropanol)进行溶解;对于疏水性非常强的多肽,先用少量的二甲基亚砜(DMSO)溶解,并用水稀释到需要的浓度。同理,如果多肽序列中包含半胱氨酸Cys(C),需使用二甲基甲酰胺(DMF)或N-甲基吡咯烷酮 (NMP)进行溶解。对于容易聚集的多肽,则选择6M的胍盐酸(guanidine?HCl)或8M的尿素(Urea)来溶解,然后稀释到需要的浓度。
问: 如何保存多肽?
答: 1. 为了方便储存及后续使用,建议将多肽溶解至浓度为1-2 mg/ml左右。
2. 为了防止或尽量减少多肽降解,请将多肽以冻干粉形式保存在-20°C,-80°C更佳。如果需要保存溶液肽,最好分成小样存放,以避免反复冻融。一份样品融冻后未用完,应扔掉。细菌降解有时会成为溶液肽的麻烦,所以请将肽溶于无菌水或肽溶液过滤除菌。
3. 多肽序列中含有甲硫氨酸Met(M),半胱氨酸Cys(C)或酪氨酸Tyr(Y),建议保存于无氧环境防止氧化。
问: 如何选择适合自己研究的多肽纯度?
答: 粗品肽不推荐用于生物实验。粗肽可能含有大量的非肽类杂质,如残留的有机溶剂、清除剂、TFA和其他不完整肽。TFA不能被完全消除,通常交付的肽以TFA盐的形式存在。如果残留的TFA影响您的实验,我们推荐其他盐形式,如醋酸盐和盐酸盐等。这些盐通常比常规TFA盐贵20-30%以上。这是由于在转化过程中出现更多的肽损失和需要更多的原材料。
NovoPro建议对各种项目采用以下级别的肽纯度:
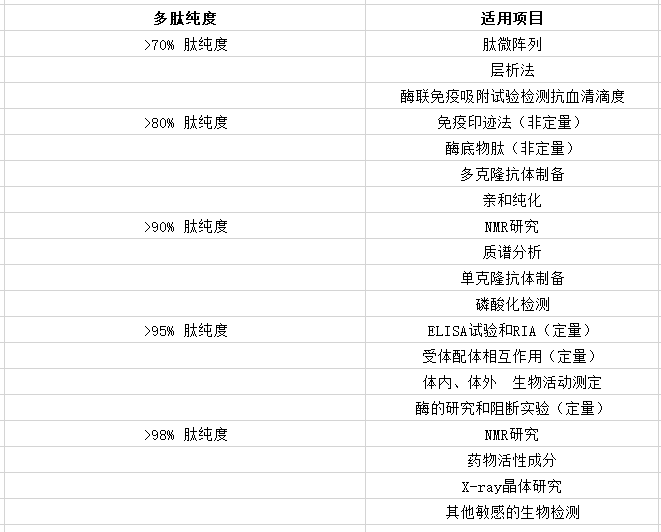
问: 收到多肽后该如何处理和保存多肽?
答: 冻干粉形式的多肽,经密封包装可在常温条件下稳定运输,溶解状态的多肽不宜长期保存。
多肽保存指南:需要长期保存的多肽,应以冻干粉形式存放在含有干燥剂的密封容器内,置于-20℃保存,-80℃效果更好,可以最大限度地避免多肽降解。这种储存方式可以使多肽可保存数年,避免了被细菌降解和氧化,也可以避免二级结构的形成。
打开包装: 在打开包装和称重前,请先将多肽在干燥器中平衡至室温。因多肽往往具有吸湿性,未经平衡到室温的多肽在打开盖子后易凝结,从而降低了多肽产品的稳定性。
称重: 迅速称取您所需的多肽,并将剩余多肽继续储存在-20°C或更低温度。与其他多肽相比,含有半胱氨酸、蛋氨酸、色氨酸、天冬酰胺、谷氨酰胺和谷氨酸N -末端的多肽保存期更短。
问: 什么是多肽的纯度?
答: 多肽的纯度是指HPLC方法在214nm处检测到的目标多肽的含量(214nm是肽链的吸收波长),紫外分光光度计检测不到水和残留的盐分。但可发现其他的杂质包括:缺失序列(缺失了一个或多个氨基酸残基的靶序列),截断序列(加帽过程中产生的序列)脱保护不完全序列(产生于整个合成过程或最后的裂解过程)。
多肽纯化不涉及水和盐。HPLC纯化会产生少量的TFA,如:游离的氨基末端和其他侧链如Arg、Lys、His都可生成少量TFA杂质。通常交付的多肽多含有微量TFA和残留水。即使处于冻干状态,水也会因共价结合的能力不同而不同程度地存在着。
在多肽中还存在哪些物质(杂质)?
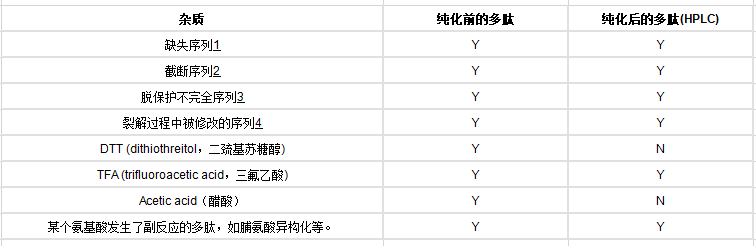
纯化前的多肽中包含的杂质包括多肽和非多肽物质, 纯化后的多肽中包含的杂质除了TFA盐,大多数为序列被修改的多肽。
1、缺失了一个或多个氨基酸残基的靶序列。
2、为避免缺失序列的产生而进行的加帽操作,截断序列即产生于加帽过程中。
3、产生于整个合成过程或最后的裂解过程。
4、保护基重新附着在多肽的其他位置。
问: 固拓生物如何对合成的多肽进行质检?
答: 所有合成肽都经过HPLC和MS分析,并提供相应的检测报告。所有多肽均采用反相色谱法纯化,以质谱法测定肽的分子量来确定产品是否正确,MS检测结果还可显示大部份的主要杂质。如果必要,还可提供肽净含量检测,如氨基酸分析或元素分析。这些方法可以证实多肽的氨基酸组成,他们均可作为多肽确认的补充方法。所有交付的肽均达到了客户要求的纯度。没有达到纯度要求的那些多肽均被丢弃。当然如果客户需要,也可以发送给他们。
问: 如何解释MALDI(MS)中的P+Na 和P+K峰?
答: 经常会在MALDI中看到Na峰和K峰,钠和钾来源于溶剂水。即便是蒸馏水和去离子水也会 含有痕量的钠离子和钾离子,无法完全除去。它们在进行质谱分析时也会离子化并与肽的自由羧基结合。因为没有纯化水的系统将水中的钠离子和钾离子除去,所以有时候在MALDI MS图谱中出现钠峰和钾峰也是再所难免的。
问: 为什么要进行N端乙酰化,C端酰胺化修饰?
答: 这些修饰可以使肽不会被降解掉,也可以使肽模拟它在母本蛋白中α氨基和羧基的原始状态。
问: 如何将多肽溶解在DMSO中?
答: 二甲基亚砜(DMSO)是一种含硫有机化合物,分子式为(CH3)2SO,常温下为无色无臭的透明液体。DMSO作为冷冻保护剂经常应用于细胞库。在细胞冷冻过程中,DMSO可防止胞内/胞外晶体的形成,其工作浓度为10%。DMSO通常可与盐或血清白蛋白结合。
疏水性多肽可以很容易地溶解在DMSO中。但DMSO可增加细胞的通透性,若多肽溶解于DMSO中则会对细胞产生毒性作用。高浓度的DMSO绝不可应用于细胞培养中。浓度为5%的DMSO即可让细胞膜溶解。大多数细胞株可以容忍0.5% DMSO,少许可以容忍1%的浓度,而不表现出严重的细胞毒性。然而原代细胞培养对其更敏感。所以如果是用原代细胞做剂量/反应曲线(可行性),其浓度应低于0.1%。
对于某些疏水性非常高的多肽,可先尝试将其溶解在少量的DMSO(30-50ul,100%)中,然后慢慢 (一滴一滴地)将其添加到不断搅拌的水溶液如PBS或其他想要的缓冲液中,直至理想浓度。如果滴加过程中,肽溶液开始变浑浊,说明已经达到了溶解极限。另外,超声波有助于多肽溶解。
经验:
对几乎所有的细胞来说,浓度为0.1%DMSO是安全的。
广泛被用于细胞培养的DMSO终浓度为0.5%,不会引起细胞毒性。
虽然对部份细胞来说,1%DMSO也不会产生细胞毒性,但我们推荐0.5%。
也有5%DMSO成功地应用于某些细胞的案例。
始终保持终浓度在0.5%,但储存时可200倍高浓度溶于100%的DMSO中。
问: 磷酸化修饰多肽的设计有什么建议?
答: 随着长度的增加,从磷酸化的那个氨基酸往后偶联效率逐渐降低。合成方向从C端到N端,建议磷酸化的那个氨基酸以后的残基不要超过10 个,也就是说从N端往C端数磷酸化氨基酸之前的氨基酸残基最好不要超过10个。
问: 如何选择多肽N端修饰和C端修饰?
答: 肽的末端默认为N端游离的氨基,C端游离的羧基。而肽的序列往往代表了母本蛋白的序列,为了与母本蛋白更为接近,肽末端往往需要封闭,即N端乙酰化,C端酰胺化,这种修饰避免引入多余电荷,也使其更能防止外切酶作用,使肽更加稳定。
问: 我需要合一条环肽,其中含有一个色氨酸,它会被氧化吗?
答: 色氨酸的氧化是肽氧化中的常见现象,而肽一般是先环化再纯化,如果其中的色氨酸发生了氧化作用,肽在HPLC柱上的滞留时间会发生变化,因此被氧化的肽可以通过纯化去除。另外,氧化的肽也可以通过MS检测到。
问: 如何确定肽已成环?
答: 一般采用Ellman反应来检测成环反应是否完全。 如果Ellman检测结果为阳性(黄色),说明成环反应不完全;如果检测结果为阴性(不是黄色),说明成环反应已进行完全。
问: 含有Cys的多肽在出货前经过还原了吗?
答: 如果没有发现肽已经被氧化,我们一般不对Cys进行还原。所有的多肽都是由粗品在pH 2条件 下纯化、冻干后得到的,这样的pH条件至少在某种程度上防止了Cys的氧化。含Cys的肽一般 在pH 2条件下进行纯化,除非有特殊原因需要在pH6.8条件下纯化。如果纯化在pH6.8进行, 纯化产物必须马上用酸处理以防氧化。在最后的质量控制环节,对于含有Cys的肽,如果MS图谱上发现有分子量为(2P+H)的物质存在,说明Cys已经氧化形成二聚体。如果MS和HPLC都没有问题,我们就直接冻干后出货。需 要指明的是,含有Cys的肽随着时间的推移会发生缓慢的氧化,氧化程度主要取决于肽序列及贮存条件。
问: 荧光标记时,肽和修饰标记的染料之间需要加一个间隔吗?
答: 多数染料属于大分子量芳香族氨基酸,为了避免多肽与荧光标签之间发生相互作用(比如,FITC很容易结合多肽序列中的半胱氨酸残基或者赖氨酸残基。),维持蛋白的构象及其生物学活性,我们推荐引入一个可弯曲的间隔区,比如Ahx, Ahx是一个含有6碳分子的环状结构,可以维持荧光标签的稳定性。
通常情况下,生物素、FITC一类的染料既可以标记在蛋白的氨基端也可以标记在蛋白的羧基端。然而,为了在最短时间内,最便捷又高效地合成多肽,固拓生物推荐客户选择标记在氨基端。因为一个多肽的合成往往是从羧基端开始的,这样一来,氨基端的修饰便成为最后一个环节,不需要再进行特别的结合作用。反之,羧基端修饰需要额外的环节,因此过程更加复杂。
问: 多肽一般有哪几种盐的形式?通过什么方式转盐或脱盐?
答: 多数多肽都是在TFA体系下分离纯化的,所以多肽以TFA盐的形式最多,其次药物肽一般有醋酸盐及盐酸盐的形式,极少数药物肽会有一些特殊的盐形式。转盐方式多为离子交换法和HPLC法,而脱盐可用G25(安马西亚出的一种葡聚糖凝胶)柱。一般醋酸盐及盐酸盐的价格比TFA的价格高出20%-30%。
问: 在多肽检测过程中经常出现基线漂移的原因是什么?怎么解决?
答: 固定三氟乙酸(TFA)浓度的梯度洗脱有时会在210-220nm检测处造成吸收基线的漂移,这是许多反相分离中基线漂移的原因。 降低或消除由于三氟乙酸光谱吸收变化引起的基线漂移需要尽量使检测波长靠近215nm,并在溶剂B中比在溶剂A中少加15%的三氟乙酸补偿基线漂移。列如,溶剂A中的三氟乙酸为0.1%时,溶剂B中可用0.085%。
问: 影响多肽纯度检测结果的因素有哪些?
答: 影响多肽纯度检测结果的因素很多,主要包括:流动相体系、色谱柱型号、柱温、波长及色谱仪的性能指标,每一项不同都可能造成结果产生误差。
问: 有哪些流动相体系或离子对试剂可用于多肽的分离纯化?
答: 目前,最常用的离子对试剂是三氟乙酸(TFA),三氟乙酸能调节洗脱液的PH,同时作为离子对试剂与多肽相互作用,从而增强分离效果,明显改善峰形。 其它可用于多肽分离纯化的流动相体系或离子对试剂包括醋酸体系,磷酸体系,盐酸体系,七氟丁酸等,通过适当的调节PH都能取得很好的分离效果。







