定制合成 Custom synthesis
联系方式 Contact Us
与小分子药物相比,多肽药物在结合蛋白相互作用靶点和G蛋白偶联受体靶点方面具有独特的优势,多肽药物的分子量远小于各种单克隆抗体或蛋白药物。
随着口服生长激素的上市,口服多肽在世界范围内的生物医学研发领域逐渐引起广泛关注。近日,美国休斯顿卫理公会学院沈海发教授发表了一篇关于长链脂肪酸靶向分子促进多肽类药物口服吸收的文章。作者将据此解读文章的核心内容。
由于胃肠道中存在胃酸、胆汁、胰酶等强酸、强碱和各种消化酶,肽类等大分子药物容易降解或变性。同时,粘膜表面的粘膜层与粘膜细胞之间的紧密连接结构也是口腔大分子不可逾越的物理屏障。当然,最重要的是分子量太大,使得肽等大分子药物通常无法通过被动扩散,通过脂质双层作用于细胞内靶点。8碳和10碳渗透促进剂(PE),如SNAC,可以通过影响肠粘膜上皮细胞刷状缘细胞膜的表面结构稳定性,在短时间内增加肠粘膜屏障的整体通透性,从而增加多肽类大分子药物如索马普肽的生物利用度,但存在肠道细菌毒素等病原体进入血液系统的风险。虽然以前的临床试验没有出现严重不良反应的报道,但显然大分子特有的肠道吸收机制是最理想的解决方案。
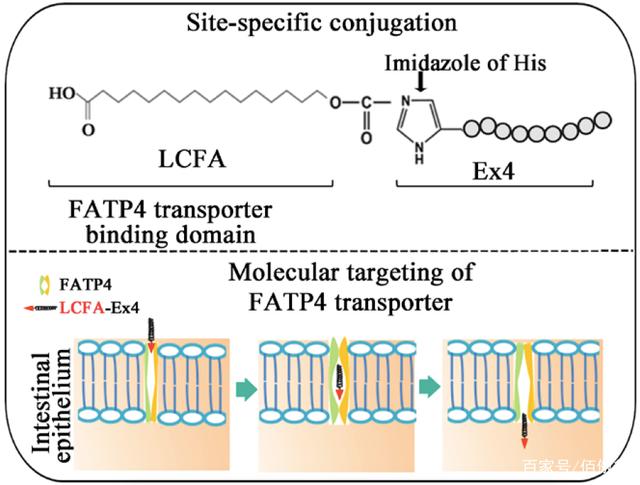
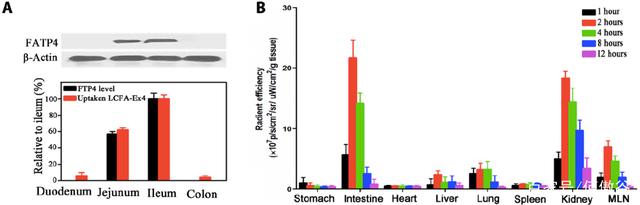
近年来,除了转铁蛋白相关的大分子转运外,长链脂肪酸(LCFA)相关的大分子转运受体也是研究热点。大量研究报道,肠粘膜细胞表面的脂肪酸转运蛋白4(FATP4)可以将肠腔内的LCFA转运至细胞,并通过内质网将LCFA从肠粘膜上皮的基侧排出至淋巴系统,从而实现LCFA的特异性吸收。本文中,沈教授的团队首先实现了与Execndin-4、Ex4(Ex4)的定点偶联,然后通过壳聚糖纳米胶囊将小分子多肽偶联药物包裹在脂质体中,最终实现Ex4的口服吸收。
LCFA-Ex4通过FATP4转运到细胞中
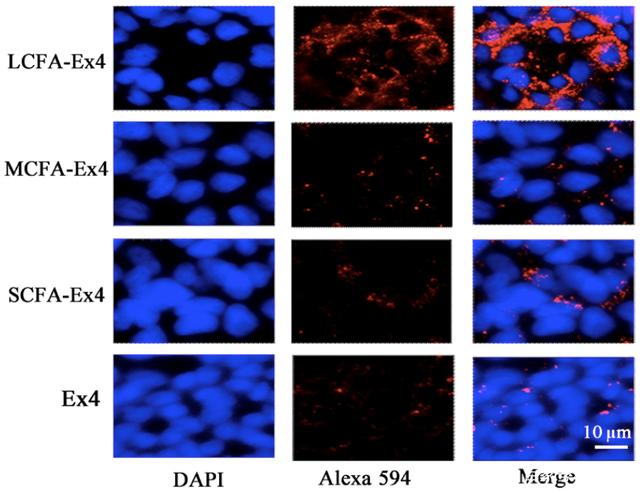
体外实验使用高FATP4表达的Caco-2人结肠癌细胞和无FATP4表达的HCC827人肺癌细胞。与此同时,Ex4分别与LCFA、MCFA和SCFA合作。激光共聚焦显微镜显示只有LCFA-Ex4能被Caco-2细胞有效吸收。
Caco-2细胞的LCFA-Ex4显著高于其他组
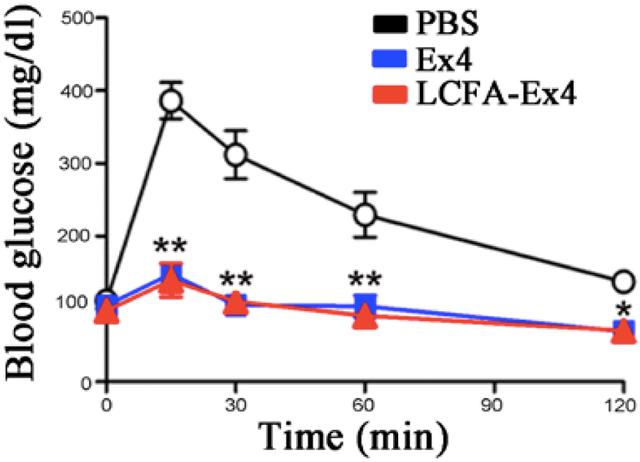
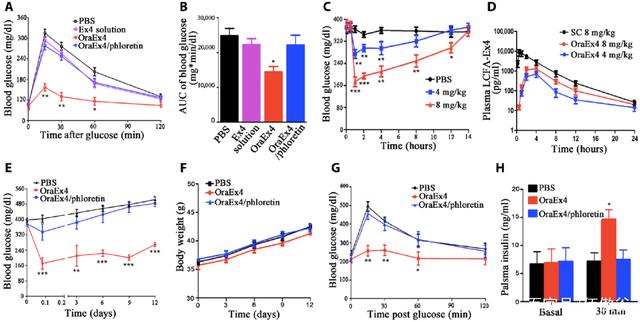
本文通过两部分反应介绍了LCFA和Ex4的偶联反应。首先,焦碳酸二乙酯与Ex4的C端组氨酸结合形成中间体,然后LCFA与该中间体偶联。目前市场上很多多肽类药物都是通过增加脂肪酸侧链,实现与血浆白蛋白的非共价结合来延长半衰期。在这项研究中,还发现LCFA-Ex4的半衰期比游离Ex4长2倍以上。口服LCFA-Ex4组的降糖效果与皮下注射Ex4组相似,比PBS对照组低59%。
口服LCFA-Ex4与皮下注射Ex4具有相同的降血糖作用
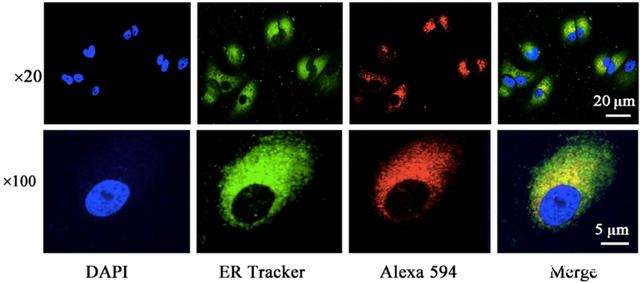
同时发现,LCFA-Ex4被FATP4吸收到肠粘膜上皮细胞,然后转运到内质网而不是溶酶体,因此Ex4最终被完全分泌到淋巴系统。
LCFA-Ex4主要分布于肠粘膜上皮细胞的内质网
为了获得更好的口服生物利用度,作者团队首先用脂质体包裹LCFA-Ex4分子,然后用壳聚糖纳米材料胶囊来抵抗胃酸等消化液的腐蚀。通过分析不同时间点小鼠不同组织中LCFA-Ex4的含量,可以发现LCFA-Ex4口服后2-4小时主要通过小肠淋巴系统吸收,通过肾脏代谢出体外。
LCFA-Ex4的吸收符合FATP4分布,主要在2-4小时内被空肠和回肠吸收
在C57BL/6和糖尿病模型db/db小鼠的动物实验中,还可以发现口服LCFA-Ex4(8mg/kg组)的血药浓度曲线与皮下注射相似,能有效降低小鼠的血糖水平。
总结一下
鉴于口服生长激素的成功上市,SNAC给药系统在实现大分子口服给药中的重要作用已得到广泛认可。单纯通过优化多肽分子的极性、氢键数目、分子量等参数,很难在短时间内实现口服生物利用度的质的突破。开发不同的药物传递系统和促进分子吸收的偶联方案是未来口服多肽药物的主要发展方向。多肽和核酸一样,很容易被各种生物酶降解,只有通过特殊的传递系统才能到达治疗组织。本文通过特殊脂质体和壳聚糖纳米材料的保护,使脂肪酸多肽缀合药物能够避免消化液的降解,最终实现高效的口服吸收。相信未来多肽口服药物的开发会有更多不同的专用制备平台技术。
原创文章如有转载,请注明出处“本文首发于固拓多肽合成生物科技有限公司(www.gotopbio.com)”
本公司的所有产品仅用于科学研究或者工业应用等非医疗目的,不可用 于人类或动物的临床诊断或治疗,非药用,非食用。