定制合成 Custom synthesis
联系方式 Contact Us
阿斯利康(AstraZeneca)和默沙东(Merck & Co)近日结合宣布,欧洲药品管理局(EMA)人用医药产品委员会(CHMP)已发布一份积极检查意见,倡议批准靶向抗癌药Lynparza(中文品牌名:利普卓,通用名:olaparib,奥拉帕利片剂),用于携带生殖系BRCA突变(gBRCAm)的转移性胰腺癌患者的一线维持治疗,详细为:在一线化疗计划中承受至少16周的含铂化疗后病情没有停顿、携带生殖系BRCA1/2突变的转移性胰腺癌成人患者。
如今,CHMP的意见将递交至欧盟委员会(EC)检查,后者估计在将来2个月内做出最终检查决议。在美国,Lynparza于2019年12月取得FDA批准,一线维持治疗gBRCAm转移性胰腺癌成人患者。Lynparza是获批治疗gBRCAm转移性胰腺癌的独一一款PARP抑止剂,除美国之外,Lynparza也已在其他几个国度取得批准,在欧盟和其他司法管辖区的监管检查正在停止中。
今年5月,Lynparza还取得美国FDA批准:(1)用于治疗携带同源重组修复基因突变(HRRm)的转移性去势抵御性前列腺癌(mCRPC)患者;(2)结合贝伐单抗(bevacizumab),用于同源重组缺陷(HRD)阳性晚期卵巢癌成人患者的一线维持治疗。
Lynparza是全球上市的第一个PARP抑止剂,可用于治疗4类癌症,包括:卵巢癌、乳腺癌、胰腺癌、前列腺癌。该药是一种首创、口服多聚ADP核糖聚合酶(PARP)抑止剂,已获批7个治疗顺应症,其中4个是卵巢癌、2个是一线维持治疗卵巢癌。详细为:(1)一线维持治疗BRCAm晚期卵巢癌成人患者;(2)结合贝伐单抗一线维持治疗HRD阳性晚期卵巢癌成人患者;(3)维持治疗复发性卵巢癌成人患者;(4)晚期gBRCAm卵巢癌成人患者;(5)治疗gBRCAm、HER2阴性(HER2-)转移性乳腺癌成人患者;(6)一线维持治疗gBRCAm转移性胰腺癌成人患者;(7)治疗承受新型激素疗法后病情停顿的HRRm、mCRPC患者。
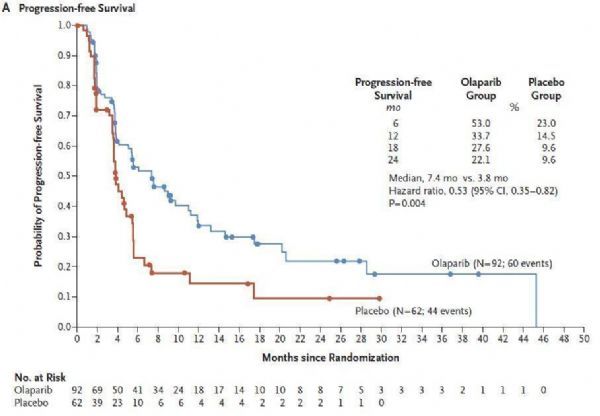
CHMP的积极检查意见,基于III期POLO实验的结果。相关数据已发表于《新英格兰医学杂志》(NEJM)。该实验标明,与抚慰剂相比,Lynparza作为一线维持治疗药物,将gBRCAm转移性胰腺癌患者的无停顿生存期进步近一倍(中位PFS:7.4个月 vs 3.8个月)、将疾病停顿或死亡风险显著降低了47%。该实验中,Lynparza的平安性和耐受性与之前的实验分歧。
值得一提的是,Lynparza是在III期临床实验中一线维持治疗gBRCAm转移性胰腺癌方面被证明对患者有益的独一一个PARP抑止剂。
默沙东研讨实验室首席医疗官、高级副总裁兼全球临床开发主管Roy Baynes表示:“胰腺癌是一种消灭性的疾病,我们努力于改动患者的预后。来自III期POLO研讨的数据标明,在某些晚期胰腺癌患者中,Lynparza治疗延长了疾病无停顿生存期。我们希望不久就能将这种疗法带给欧盟的患者。”
胰腺癌是一种致命性的癌症,有着十分高的未满足医疗需求。胰腺癌是全球第11位最常见癌症类型和第七大癌症死亡缘由,在最常见癌症中的生存率最差,在每个国度,确诊后的5年生存率仅为个位数(2-9%)。胰腺癌的早期诊断很艰难,患者通常无病症,直至病情开展至晚期时才呈现病症,大约80%的患者在转移性阶段被诊断出来,这些患者的均匀存活时间不到一年。
过去几十年来,胰腺癌诊断和治疗方面简直没有停顿,目前的治疗办法主要是手术(仅适用于10-20%的患者)、化疗和放疗,突显了对更有效治疗计划的关键未满足需求。在全球范围内,2018年约确诊46万新病例,gBRCAm胰腺癌占一切病例的5-7%。
Lynparza(利普卓):已在中国上市,并被列入国度医保目录
Lynparza于2014年12月获美国FDA批准上市,成为全球获批的首个PARP抑止剂。Lynparza是一种首创、口服PARP抑止剂,应用DNA修复途径的缺陷优先杀死癌细胞,这种作用形式赋予了Lynparza具有治疗存在DNA修复缺陷的普遍类型肿瘤的潜力。PARP与普遍的肿瘤类型相关,特别是乳腺癌和卵巢癌。目前,阿斯利康正展开多个临床研讨,调查Lynparza用于普遍类型肿瘤的潜力,包括乳腺癌、前列腺癌、胰腺癌。
阿斯利康与默沙东于2017年7月达成肿瘤学全球战略协作,共同开发和商业化Lynparza及另一种MEK抑止剂selumetinib治疗多品种型肿瘤。阿斯利康对Lynparza寄予了十分高的希冀,以为该药的年销售额将打破20亿美圆。
在中国市场,Lynparza(利普卓)于2018年8月23日取得中国国度药品监视管理局(CNDA)批准,用于铂敏感复发性卵巢癌的维持治疗。此次批准,使Lynparza成为中国市场首个获批治疗卵巢癌的靶向药物,标志着中国卵巢癌治疗进入PARP抑止剂时期。
2019年12月初,Lynparza(利普卓)再次获批,用于BRCA突变晚期卵巢癌患者的一线维持治疗。受益于中国鼎力支持医药创新及加速推进临床急需新药审批,Lynparza(利普卓)成为中国首个获批用于卵巢癌一线维持疗法的PARP抑止剂。2019年11月28日,Lynparza(利普卓)被列入国度医保目录。
原创文章如有转载,请注明出处“本文首发于固拓多肽合成生物科技有限公司(www.gotopbio.com)”
本公司的所有产品仅用于科学研究或者工业应用等非医疗目的,不可用 于人类或动物的临床诊断或治疗,非药用,非食用。
- 上一条:我国科学家发现新型广谱抗菌增效剂
- 下一条:病毒起源地到底是哪?谎言最终还是会被戳穿