定制合成 Custom synthesis
联系方式 Contact Us
4 月 10 日,权威医学期刊《新英格兰医学杂志》(New England Journal of Medicine) 登载了吉利德科学公司关于饱受关注的 COVID-19 “特效药”瑞德西韦(Remdesivir)临床实验科学报告。结果显现,在提供的有限的临床数据中,有68%的重症新冠肺炎患者临床病症由于瑞德西韦的治疗而得到了改善。
该临床实验报告共汇总了 53 例已被确诊为 COVID-19 并住院的患者数据,其中包括美国 22 例、欧洲和加拿大共 22 例,日本 9 例。
在开端实验之前,64% 患者曾经在承受呼吸机的治疗,包括 4 例承受外膜氧合治疗(ECMO)的患者。在 1 月 25 日至 3 月 7 日期间,一切患者均承受了为期 10 天的瑞德西韦药剂的注射治疗,第一天静脉注射 200mg,其他 9 天每天 100mg。
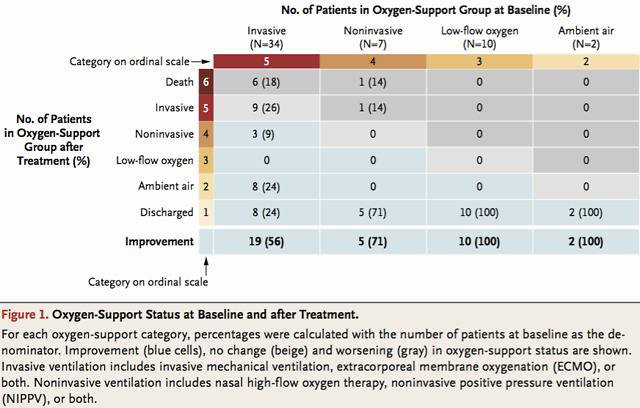
结果剖析显现,68% 的患者在初次承受瑞德西韦的注射治疗后,氧支持级别得到改善:治疗前未采用呼吸机的病人较采用呼吸机的病人在承受瑞德西韦治疗后病症改善更为明显;而先前承受机械通气治疗的患者中,57% 的患者曾经拔掉了气管插管;共有 23 例患者在治疗后曾经出院。
依据随访 28 天后的测算结果显现,在选取置信区间 95% 的状况下,患者承受瑞德西韦治疗后临床病症的改善率为 84%。
基线和治疗后的氧支持状态,氧支持状态改善(蓝色),无变化(米色)和恶化(灰色)。依据图表我们能够看出,蓝色和米色占绝大局部面积,而灰色区域集中在重症患者的样本中。
实验数据标明,大多数严重 COVID-19 患者在承受药物治疗后都有显著的改善。
结果虽看起来让人欢天喜地,但作为一种实验阶段的药物,瑞德西韦也对局部病患产生了水平不一的反作用。在承受注射的患者中,约有四分之一呈现严重的反作用,包括多器官功用障碍综合征、感染性休克、急性肾损伤和低血压。另有 23% 的患者在实验室检测中显现出肝脏损伤的迹象。四名患者不得不完整中止承受药物注射。
新冠肺炎“新希望” 的前世今生
瑞德西韦是吉利德科学公司的在研药品,该公司以研讨针对病学难题如艾滋病,乙型肝炎,丙型肝炎为重点范畴,局部产品曾经应用到临床治疗中。
瑞德西韦一种核苷类抗病毒药物,作用机理源于其对 RNA 依型的 RNA 复制酶(RdRp)的抑止作用。其开发的目的是对立埃博拉病毒,而在相关的临床实验结果中,瑞德西韦对立埃博拉病毒的效果并不理想,并且对局部患者表现出严重的反作用,瑞德西韦最终未能上市胜利。
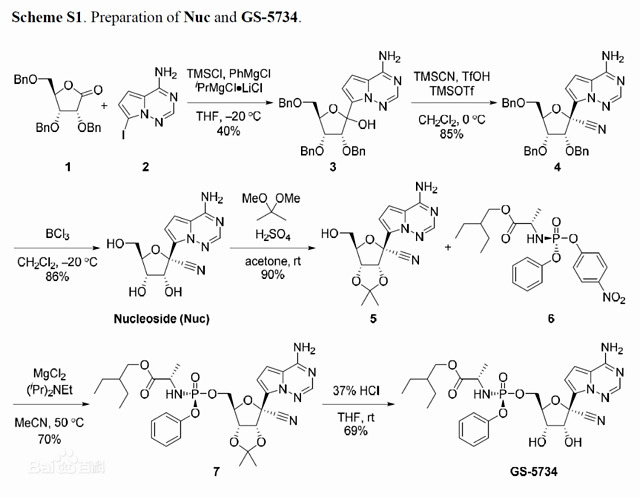
瑞德西韦的合成过程
值得留意的是,此次全球疫情大盛行的罪魁祸首——新型冠状病毒,与埃博拉病毒的遗传物质相似,均是单股正链的 RNA 病毒,这也意味着他们的增值过程具有一定的类似性。
2020 年 1 月 31 日,《英格兰医学杂志》在线发表了多篇关于新型冠状病毒(2019-nCoV)病例的论文,其中一篇引见了美国首例确诊病例的诊疗过程以及临床表现,阐明了一种名叫 remdesivir(瑞德西韦)的药物在抗新型冠状病毒时展示出较好的疗效,但其有效性还要经过大范围临床实验才干得到进一步考证。
在对美国的一例新冠病毒感染重症病例的治疗中,医生试用了尚在临床研讨阶段的药物——瑞德西韦,病人的病情得到了较好的缓解,《英格兰医学杂志》对美国这位武汉省亲后返回华盛顿州的首例病人停止报道,自此,瑞德西韦因新冠疫情迸发一下子进入人们视野,成为大家等待的“神药”。
由于其可能是治疗新冠肺炎的潜在有效药物,在疫情期间,我国药审部门也快速启动了瑞德西韦的绿色通道,疾速批准了瑞德西韦在我国新冠肺炎患者治疗中展开3期临床,目前这项临床研讨实验也正在停止中,这项研讨参与者有700多例,详细的临床研讨结果会在4月底发布。
为何停顿迟缓?
从一月份新闻媒体漫山遍野关于瑞德西韦的治愈性成果报告,到二月份中国与吉利德公司宣布协作招募意愿者开端实验,再到美国总统特朗普表示对瑞德西韦的宏大信任,这个直接被我们音译成“人民的希望”的神药瑞德西韦,为何至今停顿迟缓,实验结果尚不明白呢?
3 月 24 日,FDA 将瑞德西韦批准为“孤儿药”,顺应症被表述为:治疗新型冠状病毒感染。但富有戏剧性的是,在取得孤儿药批准后,吉利德公司向 FDA 申请撤回这项批准,并放弃有关孤儿药的一切相关权益。吉利德公司称,完整有自信心经过正常临床程序取得批准。
所谓“孤儿药”,是用于治疗稀有病而特殊批准的一类药物,FDA 为开发“稀有病”疗法的制药公司提供为期 7 年的市场独占期,且该维护不受专利的影响。
这就与理想相悖,新冠本是一个全球大盛行病,具有着普遍的市场需求,却被批准为“孤儿药”独享专利。而吉利德相关担任人曾表示“并不想卷入专利纠葛”,这可能是促成吉利德撤回申请的缘由之一。
并且,到目前为止,也没有足够的临床研讨数据证明瑞德西韦在临床上,治疗新冠肺炎是普遍有效的,其有效性到底如何,用药平安性又怎样样?这些问题都有待于更多的临床数据来证明,而假如不经临床运用证明,而快速被批准,在运用过程中呈现有效性或平安性方面的问题,也是相关公司所不能接受的。
并且,真正的医学实验在短短两三个月内是难以完成的。医学用于检验药品疗效的临床实验实践上是一项浩荡的工程,每检验一种药物,都需求耗大量的资源,假若以 100 位患者作为实验药物的承受群体,那么规范的临床实验则请求还需 100 位条件近乎相同的病患作为对照组,除实验组承受新型药物治疗之外,相关医护人员必需对两组病患采取近乎相同的治疗措施。而为了检验一种药品各个方面的作用效果,常常需求很多组临床实验。
而据中国关于瑞德西韦的临床实验,其入组规范有 7 项,包括间隔发病时间小于 12 天,并且在筛查评价 30 天内没有承受过任何针对新冠病毒的实验性治疗,而在此之前相关新闻媒体大肆吹捧的“双黄连”,很多患者很可能就曾经服用过而被扫除在外——单此两个规范就扫除了大局部的患者。
同时,除了入组实验规范高,还要思索患者意愿的问题,并不是一切患者都同意承当反作用,无担保的风险去尝试新型的药物治疗。
固然此次的实验报告表现出了瑞德西韦治疗的积极成果,但由于数据集和剖析的局限性,该剖析并不能为瑞德西韦的疗效提供决议性的证据支持。
吉利德科学首席医疗官、医学博士、医学博士 Merdad Parsey 也表示说:“固然这项同情用药剖析的结果令人鼓舞,但数据有限。吉利德曾经有多个临床实验正在停止,我们的目的是尽快增加越来越多的证据,更全面地评价 remdesivir 的潜力,并在恰当时支持更普遍地运用这种研讨药物。”
原创文章如有转载,请注明出处“本文首发于固拓多肽合成生物科技有限公司(www.gotopbio.com)”
本公司的所有产品仅用于科学研究或者工业应用等非医疗目的,不可用 于人类或动物的临床诊断或治疗,非药用,非食用。